Hydrophile Verbindungen sind diejenigen, die eine Affinität zu Wasser haben und sich gut in Wasser lösen. Dies liegt in der Regel an der Präsenz polarer Gruppen oder Ionen, die Wasserstoffbrückenbindungen mit Wasser eingehen können. Untersuche alle gegebenen Verbindungen auf polare Gruppen.
Hydrophile Verbindungen sind diejenigen, die eine Affinität zu Wasser haben und sich gut in Wasser lösen. Dies liegt in der Regel an der Präsenz polarer Gruppen oder Ionen, die Wasserstoffbrückenbindungen mit Wasser eingehen können. Untersuche alle gegebenen Verbindungen auf polare Gruppen.

Bist du ein Player?
Im Vollzugang erwarten dich alle Lösungsschritte für alle Ham-Nat-Altfragen, zusammengestellt von Expert*Innen und sorgfältig kuratiert, um dir beim Erreichen deiner Ziele zu helfen.
Polare Gruppen sind funktionelle Gruppen in Molekülen, die durch einen signifikanten Unterschied in der Elektronegativität zwischen den Atomen gekennzeichnet sind. Dieser Unterschied führt zu einer ungleichmäßigen Verteilung der Elektronen, wodurch ein elektrisches Dipolmoment entsteht. Polare Gruppen können Wasserstoffbrückenbindungen und andere intermolekulare Wechselwirkungen eingehen, was ihre Löslichkeit in polaren Lösungsmitteln wie Wasser erhöht. Beispiele für polare Gruppen wären Hydroxylgruppen ($-OH$), Carbonylgruppen ($C=O$), Carboxylgruppen ($-COOH$) und Aminogruppen ($-NH_2$).
Unpolare Gruppen hingegen sind funktionelle Gruppen in Molekülen, die entweder aus Atomen mit ähnlicher Elektronegativität bestehen oder eine symmetrische Struktur aufweisen, sodass die Elektronen gleichmäßig verteilt sind. Diese Gruppen haben kein signifikantes Dipolmoment und sind in der Regel hydrophob, d.h., sie lösen sich schlecht in Wasser, aber gut in unpolaren Lösungsmitteln wie Hexan oder Benzol. Beispiele für unpolare Gruppen sind Alkylgruppen (wie Methyl $-CH_3$ und Ethyl $-C_2H_5$) und aromatische Ringe (wie Benzol).
Untersuchen wir nun gegebene Moleküle auf diese Eigenschaften.
Benzol ($C_6H_6$) ist ein nicht-polares, aromatisches Kohlenwasserstoffmolekül. Da es keine polaren Gruppen oder Ionen enthält, ist Benzol hydrophob und schlecht wasserlöslich.
Natriumacetat ($CH_3COONa$) ist ein Salz, bestehend aus dem Acetat-Ion ($CH3COO^−$) und einem Natrium-Ion ($Na^+$). Da es eine Säuregruppe enthält und ionisch ist, ist es stark polar. Daher ist Natriumacetat hydrophil und sehr gut wasserlöslich.
Aceton ($CH_3COCH_3$) enthält eine Carbonylgruppe ($C=O$), die stark polar ist und Wasserstoffbrückenbindungen mit Wasser eingehen kann. Daher ist Aceton hydrophil und gut wasserlöslich.
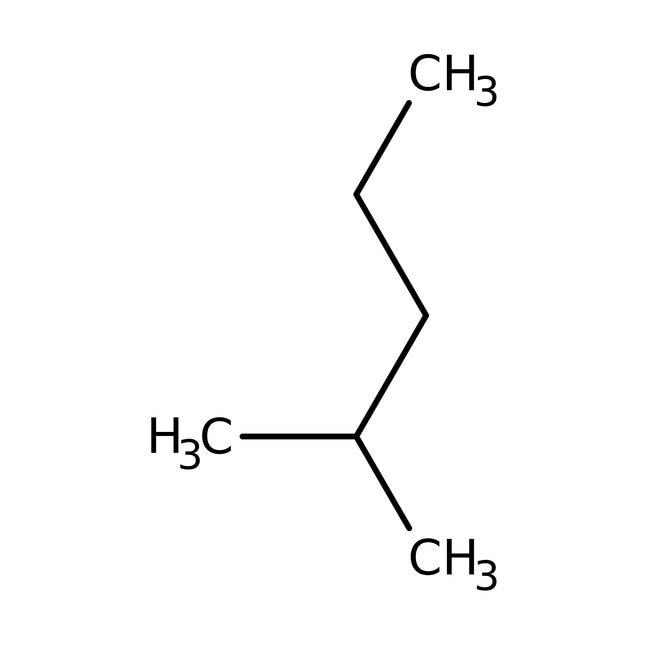
Isohexan ($CH_3CH_2CH_2CH(CH_3)_2$) ist ein verzweigter, unpolarer Kohlenwasserstoff. Da es keine polaren Gruppen oder Ionen enthält, ist Isohexan hydrophob und schlecht wasserlöslich.
Insgesammt sind Natriumacetat und Aceton die einzigen hydrophilen Verbindungen unter den gegebenen.
#
c00500

Grundkenntnisse über hydrophil oder lipophil sind absolute Standarts und kommen in vielen Aufgaben vor. Lerne daher hier auch Details zur Funktion dieser Phänomene.