Benzol (C₆H₆) ist ein Ring aus sechs Kohlenstoffatomen, bei dem sich zwischen den Kohlenstoffatomen abwechselnd Einfach- und Doppelbindungen befinden. Um die Hybridisierung der Kohlenstoffatome in Benzol zu bestimmen, müssen wir uns die Bindungen und die Elektronenkonfiguration der Kohlenstoffatome anschauen.
Welche Eigenschaft haben die Bindungen der Kohlenstoffatome?
Benzol (C₆H₆) ist ein Ring aus sechs Kohlenstoffatomen, bei dem sich zwischen den Kohlenstoffatomen abwechselnd Einfach- und Doppelbindungen befinden. Um die Hybridisierung der Kohlenstoffatome in Benzol zu bestimmen, müssen wir uns die Bindungen und die Elektronenkonfiguration der Kohlenstoffatome anschauen.
Welche Eigenschaft haben die Bindungen der Kohlenstoffatome?

Bist du ein Player?
Im Vollzugang erwarten dich alle Lösungsschritte für alle Ham-Nat-Altfragen, zusammengestellt von Expert*Innen und sorgfältig kuratiert, um dir beim Erreichen deiner Ziele zu helfen.
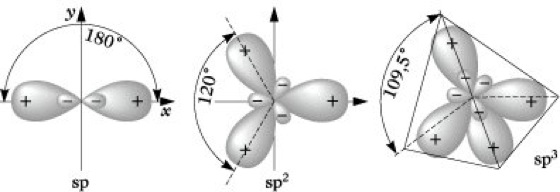
Da jedes Kohlenstoffatom drei Nachbarn hat (zwei C-Atome und ein H-Atom), und da die Elektronen delokalisiert sind, was bedeutet, dass die Doppelbindungen nicht fest einem Atompaar zugeordnet sind, sondern über den ganzen Ring verteilt sind, wird für diese Konfiguration die sp²-Hybridisierung verwendet. Bei der sp²-Hybridisierung werden ein s-Orbital und zwei p-Orbitale kombiniert, um drei sp²-hybridisierte Orbitale zu bilden, die in der Ebene des Benzolrings liegen, mit einem verbleibenden p-Orbital, das senkrecht dazu steht und für die delokalisierten π-Bindungen verwendet wird.
#
C00324

Für die Hybridisierung recht es wenn du dir merkst:
sp3-Hybridisierung: 4 Bindungspartner Bindungswinkel: 109,5°
sp2-Hybridisierung: 3 Bindungspartner Bindungswinkel: 120°
sp1-Hybridisierung: 2 Bindungspartner Bindungswinkel: 180°
Das genaue Verständniss und die Herleitung dessen kannst du dir grob angucken, dies ist jedoch deutlich ein Randthema. Zudem wird falls eine Aufgabe dazu gestellt wird, wie hier meist Kohlenstoff in Verschiedenen Konfigurationen verwendet.